Основное уравнение идеального газа: принципы и применение
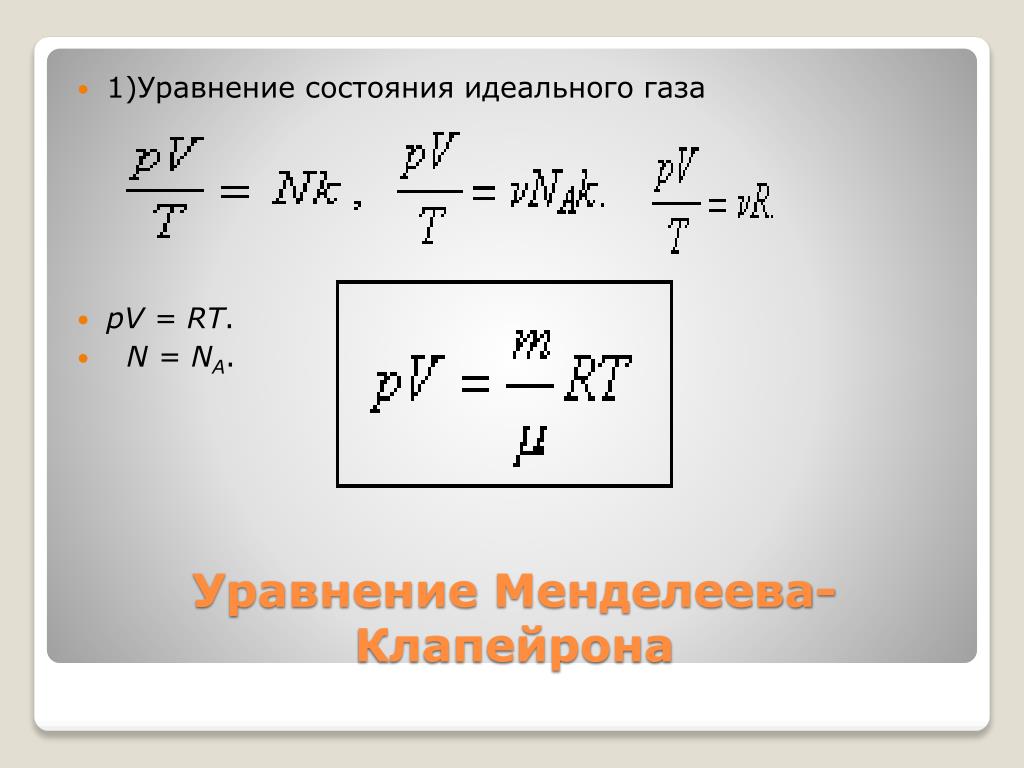
Уравнение состояния идеального газа является фундаментальной основой термодинамики, описывающей поведение идеализированного газа. Оно связывает давление, объем и температуру, позволяя проводить расчеты, необходимые для понимания свойств газов в различных условиях. Это уравнение помогает в изучении и прогнозировании химических реакций, инженерных задач и даже космических исследований.


Помните, что уравнение идеального газа - это приближенная модель. Оно лучше всего работает при высоких температурах и низких давлениях.
СТАРТ КУРСА «ХимФак 2023» - 1 урок - Строение атома - Екатерина Строганова - 100балльный репетитор


Используйте уравнение состояния PV=nRT, где P — давление, V — объем, n — количество вещества (в молях), R — универсальная газовая постоянная, T — температура (в Кельвинах).
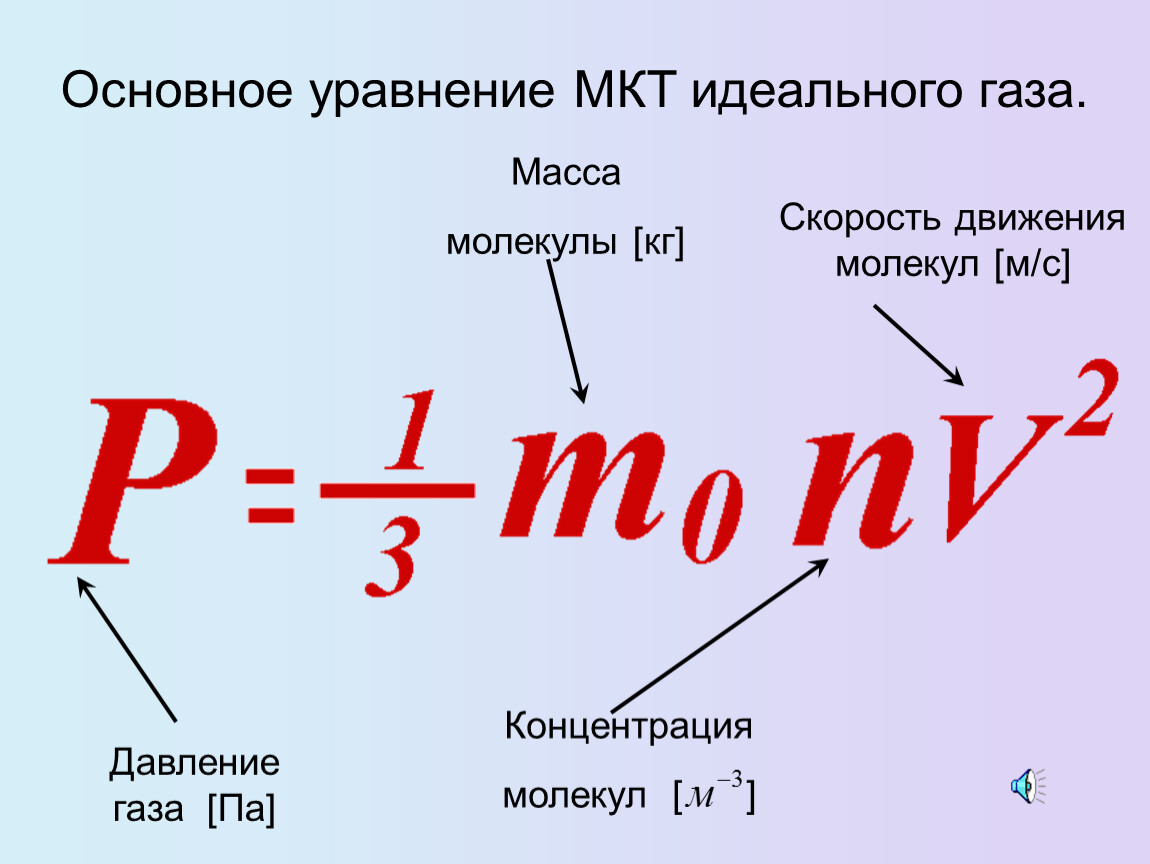
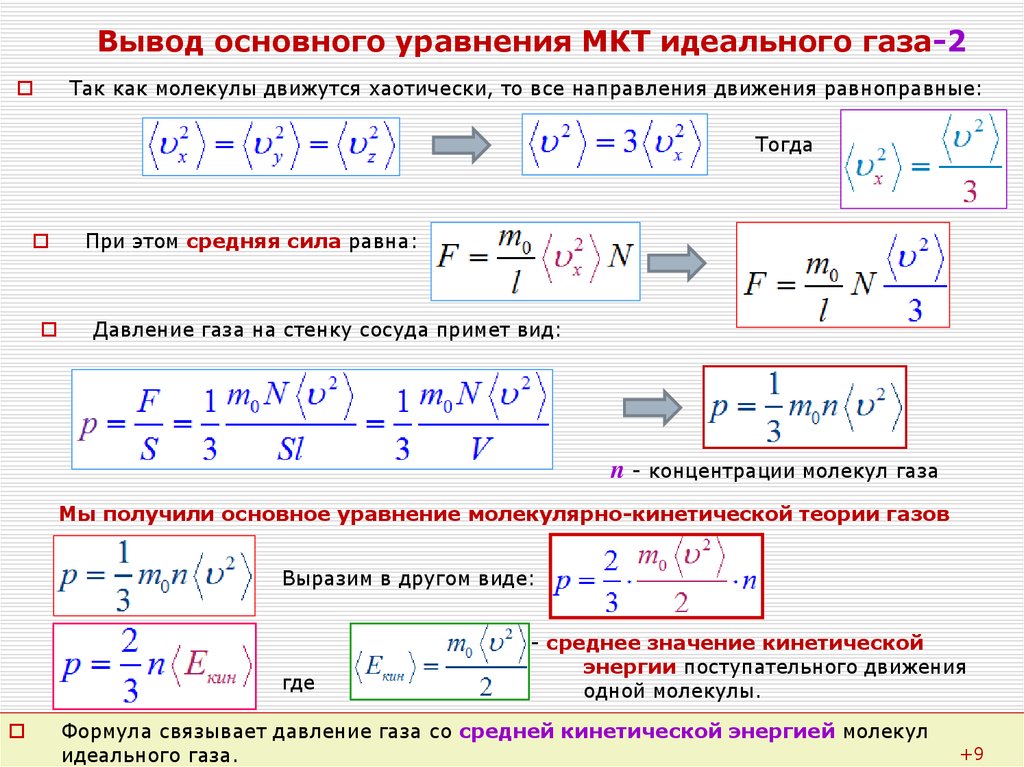
Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.
При расчетах всегда переводите температуру в Кельвины, добавляя 273.15 к значению в градусах Цельсия.
Органическая химия с нуля - Химия ЕГЭ 2023 - Умскул

Понимание концепции идеального газа полезно для изучения реальных газов, так как оно служит базисом для более сложных моделей.


В инженерии уравнение идеального газа часто применяется для определения изменения состояния газа в термодинамических процессах.
Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1

Уравнение идеального газа упрощает изучение процессов в химии и физике, однако для высокоточных расчетов требуется учитывать отклонения от идеальности.

Формула идеального газа помогает в понимании объемных изменений газов при постоянном давлении или температуре.
Не забывайте, что при низких температурах и высоких давлениях реальное поведение газов может значительно отличаться от идеального.
Слив 1 Урока Химфака 2025 - Основные понятия химии. Строение атома. Изотопы - Катя Строганова


Используйте уравнение идеального газа для быстрого анализа химических реакций, особенно в газовой фазе.
Регулярно проверяйте единицы измерения при расчетах, чтобы избежать ошибок в вычислениях.